
| 販売名 | デリタクト®注 |
| 一般的名称 | テセルパツレブ |
| 製造販売者 | 第一三共株式会社 |
| 対象疾患 | 悪性神経膠腫 |
| 承認日/保険収載日 | 条件及び期限付承認 2021年6月11日/2021年8月12日 |
| 保険償還価格 | 1mL 1瓶 1,431,918円 (保険償還価格の算定) |
| 関連文書 | 添付文書 (PMDAウェブサイト) 審査報告書 (PMDAウェブサイト) 申請資料概要 (PMDAウェブサイト) |
【製品概要】
第一三共株式会社 デリタクト製品情報サイト
デリタクト®注(以下、デリタクト)は、悪性脳腫瘍である悪性神経膠腫を対象とするがん治療用ウイルス製品です。東京大学医科学研究所の藤堂具紀(ともき)教授らのグループにより研究、開発、医師主導治験が行われ、その結果を基に第一三共社が条件及び期限付承認として製造販売承認を取得しました。
デリタクトは単純ヘルペスウイルス1型(口唇ヘルペスのウイルス)に人工的に3つのウイルス遺伝子を改変した腫瘍溶解性ウイルス製品であり、がん細胞内でのみ増殖し、癌細胞を死滅させます。腫瘍溶解性ウイルス製品としては、国内初の承認となります。
薬価は1回投与分(1mL/1瓶)あたり143万1918円であり、保険償還価格の算定における市場規模予測では、ピーク時(販売開始10年目)の使用患者数208人、販売金額12億円と予測されています。
製品名(販売名)の由来は、開発名のG47Δに由来する”delta”と”active”の組み合わせです。
【対象疾患と作用メカニズム】
対象疾患
悪性神経膠腫のうち、既存の治療法(放射線治療及びテモゾロミド)の治療歴を有する患者が対象となります。神経膠腫(こうしゅ)はグリオーマとも呼ばれる代表的な悪性脳腫瘍です。初期治療として手術および放射線治療に化学治療を組み合わせた治療が行われますが、数カ月から数年で再発することも多く、再発に対する標準治療はまだ確立されていません。
東京大学医科学研究所附属病院 脳腫瘍外科 藤堂具紀教授らの研究グループによる初期治療後に残存または再発した膠芽腫(神経膠腫の中で最も悪性度が高い腫瘍)を対象とした第2相医師主導治験では、他の複数の臨床試験結果から算出された標準治療の一年生存割合が15%であったのに対し、デリタクト投与患者の一年生存割合は92.3%と高い効果が見られています(参照:国立大学法人東京大学、国立研究開発法人日本医療研究開発機構 平成31年2月13日プレスリリース)。
構造および作用メカニズム
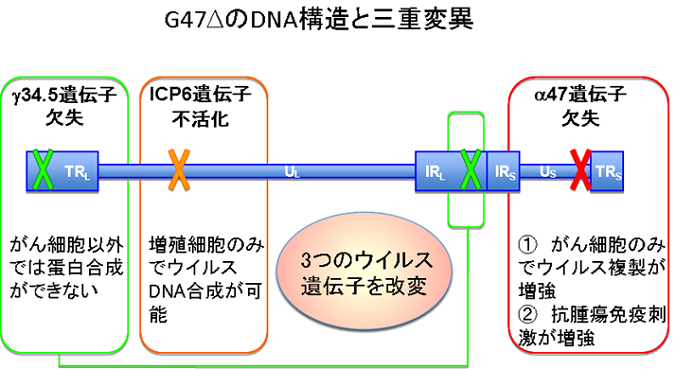
デリタクトは単純ヘルペスウイルス1型の3つのウイルス遺伝子(γ34.5遺伝子、ICP6遺伝子、α47遺伝子)を改変することで、癌細胞内でのみウイルスの増殖が可能、かつ抗腫瘍免疫が増強されるように設計されています。
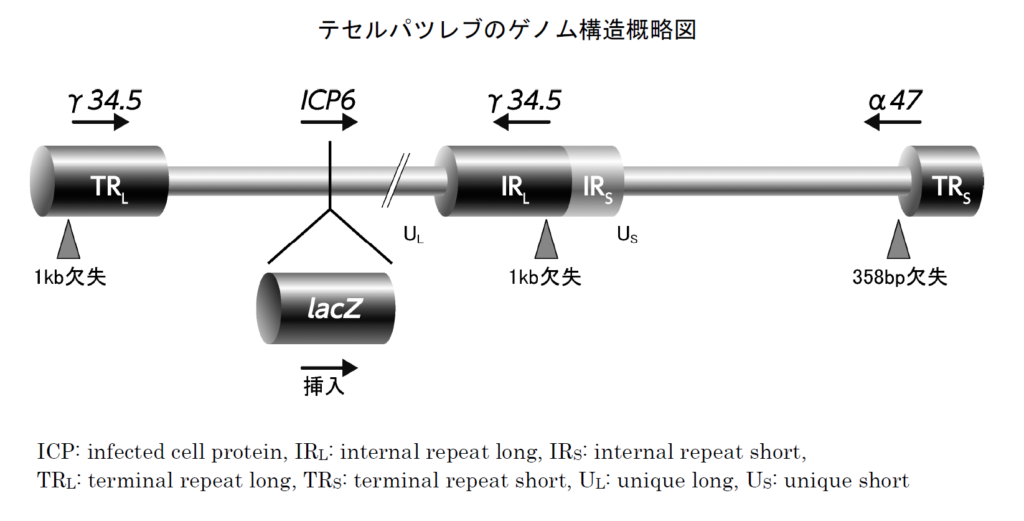
γ34.5遺伝子およびICP6遺伝子は細胞内でのウイルス複製に関わる遺伝子です。
γ34.5遺伝子は、正常細胞が有するウイルス感染に対する防御反応を阻害して、病原性を発揮するのに必要な遺伝子です。この遺伝子を欠失させることで正常細胞内では防御反応によりウイルス複製能が弱くなりますが、腫瘍細胞では防御能自体が機能していないため、ウイルスの複製が可能です。
ICP6遺伝子はウイルスDNA合成に必要な酵素をコードする遺伝子であり、この遺伝子を変異・不活化させることでウイルス複製ができなくなりますが、腫瘍細胞ではこのICP6遺伝子を補完する酵素が豊富に存在するため、ウイルスの複製が可能です。
α47遺伝子は抗腫瘍免疫に関わる遺伝子です。
α47遺伝子は感染した細胞表面のMHC classⅠの発現を低下させ、これにより免疫による攻撃を回避しますが、この遺伝子を欠失させることで腫瘍細胞は免疫を回避できず、抗腫瘍作用が増強します。
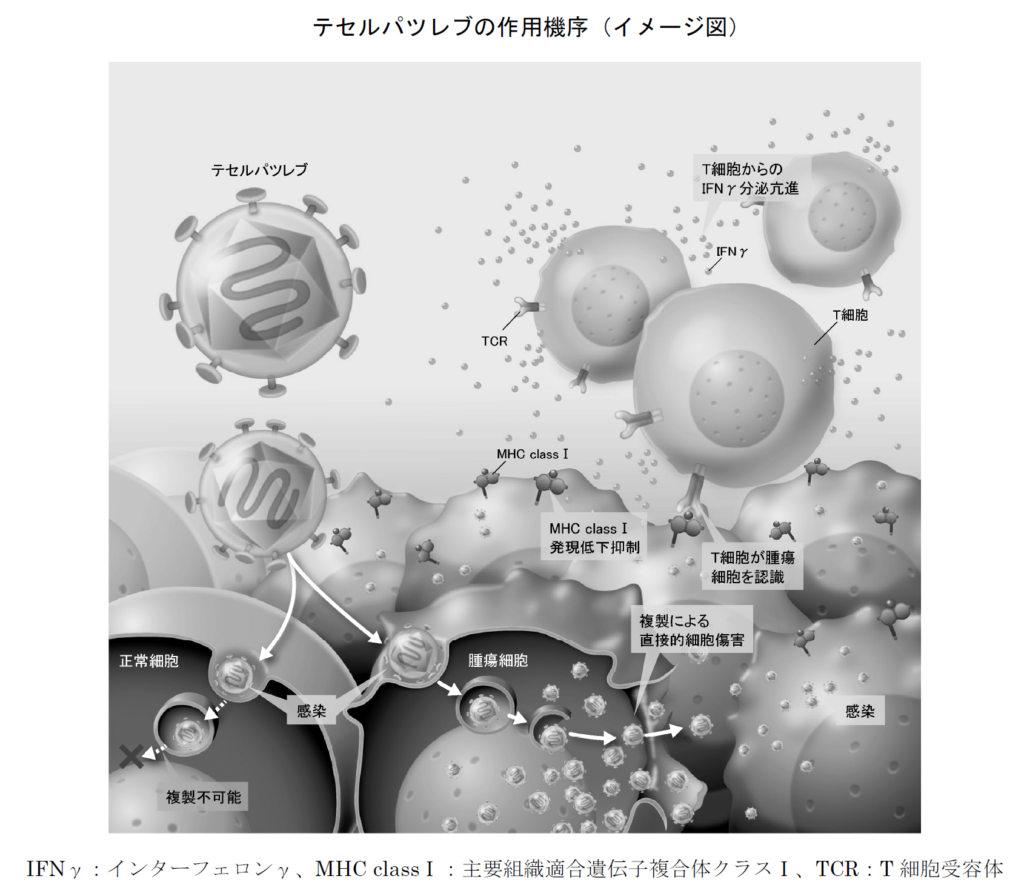
このように、デリタクトは腫瘍細胞内で選択的に増幅したウイルスによる直接的な細胞傷害、および抗腫瘍免疫の増強により抗腫瘍効果を発揮します。
【製造および治療の流れ】
デリタクトの製造は、長年に亘りウイルス感染症ワクチンとウイルス検査試薬の開発・製造を行ってきた実績があり、デリタクトの開発において藤堂具紀教授らと共に商用製造工程の開発を進めてきたデンカ株式会社が受託しています。
治療時には、1回あたり1mL(1瓶)を腫瘍に直接投与します。最大6回までの投与とされています。
【条件及び期限付承認】
デリタクトは条件及び期限付承認として承認されています。条件及び期限は以下となります。
〈承認条件〉
- 緊急時に十分対応できる医療施設において、悪性神経膠腫の治療及び脳神経外科手術手技に十分な知識・経験を持つ医師が、本品の臨床試験成績及び有害事象等の知識を十分に習得した上で、臨床検査等によるモニタリングや管理等の適切な対応がなされる体制下で本品を使用すること。
- 条件及び期限付承認後に改めて行う本品の製造販売承認申請までの期間中は、本品を使用する症例全例を対象として製造販売後承認条件評価を行うこと。
- 「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成15年法律第97号)」に基づき承認された第一種使用規程を遵守して本品を用いるよう、その使用規程の周知等、必要な措置を講ずること。
〈期限〉
7年
【アカデミア主導の開発】
デリタクトの開発においては、発明から実用化まで一貫してアカデミア主導で実施されたことが特徴として挙げられます。アカデミアでの研究を基に製薬開発が進められる場合、通常はある程度開発が進んだ段階で製薬企業に導出され、製薬企業での開発、企業治験を経て医薬品化されます。デリタクトの開発では、基礎研究後の非臨床試験から治験製品製造、規制対応、治験実施まで製薬企業が全く関与せずにアカデミアだけで行っており、「日本の医薬品・再生医療等製品開発の歴史に残るアカデミア主導創薬の成功例」であると述べられています(参照:東京大学医科学研究所 2021年6月10日プレスリリース)。
通常の薬事申請においては、有効性の評価のために大規模な治験が必要とされ、そのためアカデミアのみでの実施は難しく製薬企業が担うことが必要となりますが、小規模な治験データでも評価、承認が可能な条件及び期限付承認制度だからこそアカデミア主導創薬が可能となったと考えられます。今後もこのような事例が増えていくか注目されます。
