| 販売名 | キムリア®点滴静注 |
| 一般的名称 | チサゲンレクルユーセル |
| 製造販売者 | ノバルティスファーマ株式会社 |
| 対象疾患 | 1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性 白血病(25歳以下の患者が対象)。 2. 再発又は難治性のCD19陽性のびまん性大細胞型B細胞リ ンパ腫。 (承認:2019年3月26日/保険収載:2019年5月22日) |
| 再発又は難治性の濾胞性リンパ腫 (承認:2022年8月26日) | |
| 保険償還価格 | 3349万3407円 (保険償還価格の算定) → 3,264万7,761円 (2021年7月1日より適用) |
| 関連文書 | 添付文書 (第8版 2023年8月改訂) (PMDAウェブサイト) インタビューフォーム (第7版 2023年8月改訂) 承認情報、最適使用推進GL等(PMDAウェブサイト) |
【製品概要】
ノバルティス社 キムリア情報サイト
キムリア®点滴静注(以下、キムリア)は、再発性または難治性のCD19陽性B細胞性急性リンパ芽球性白血病(B-ALL)、およびCD19陽性びまん性大細胞型B細胞リンパ腫(DLBCL)に対する再生医療等製品です。CD19を特異的に認識するキメラ抗原受容体(CAR)発現遺伝子を患者由来のT細胞に導入したCAR-T細胞と呼ばれる自家T細胞免疫治療製品です。
ペンシルヴァニア大学のCarl H. Juneらにより開発されたCAR-T技術をノバルティス社(Novartis International AG)がライセンス導入し開発を進め、日本を含む国際共同第II相臨床試験が行われました。2017年にアメリカ、2018年に欧州でそれぞれ承認され、日本ではノバルティスファーマ株式会社が2019年3月に製造販売承認を取得しています(条件及び期限付承認ではありません)。保険収載価格3349万3407円は、当時の薬価基準収載品の単価としては国内の史上最高額でした。市場規模としては、ピーク時の患者数216人、販売金額72億円と予想されています。
【対象疾患と作用メカニズム】
対象疾患
再発性または難治性のCD19陽性B細胞性急性リンパ芽球性白血病(B-ALL)、およびCD19陽性びまん性大細胞型B細胞リンパ腫(DLBCL)が対象です。
B細胞性急性リンパ芽球性白血病は、B細胞のがん化による白血病で、主に6歳以下の小児に多く発症します(好発年齢2-3歳)。日本国内の急性リンパ性白血病患者数は約5,000人で、その内B細胞性が80-85%を占めています。びまん性大細胞型B細胞リンパ腫は、大型のB細胞性腫瘍細胞による白血病で、一面に広がる(=瀰漫(びまん))ように増殖します。あらゆる年齢で発症し、悪性リンパ腫の30-40%を占めています。日本国内の患者数は約2万1000人です。
これらの疾患では、まず既存の抗がん剤を用いた標準治療が行われますが、無効、もしくは再発の場合、次に造血幹細胞移植が行われます。それでも効果が見られない再発または難治性のものがキムリアの対象となります。
構造および作用メカニズム
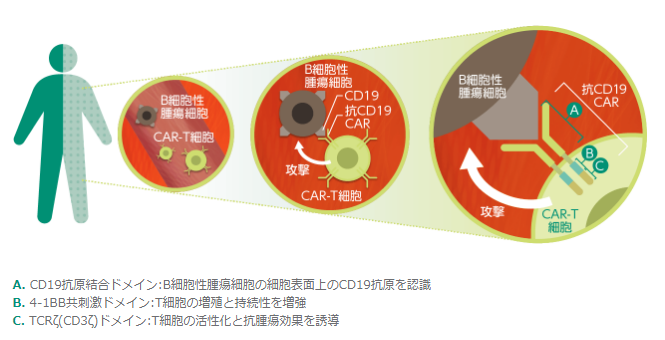
キムリアは、CAR-T技術を応用した抗がん細胞製品です。CAR-Tとは、標的となる抗原を認識する部位(上図A)と、T細胞受容体の細胞傷害性機能部分(上図BとC)から構成されるキメラ抗原受容体(CAR: Chimeric Antigen Receptor)を発現させたT細胞です。キムリアは、標的抗原としてB細胞に発現するCD19を認識し、細胞傷害性機能部分は、T細胞の増殖と持続性を増強する働きがある4-1BB共刺激ドメインとT細胞の活性化と抗腫瘍作用の誘導に重要な役割を果たすTCRζから構成されます。
CARの構造については、下図のように各社によりいくつかのパターンの開発が進められています。

【製造および治療の流れ】
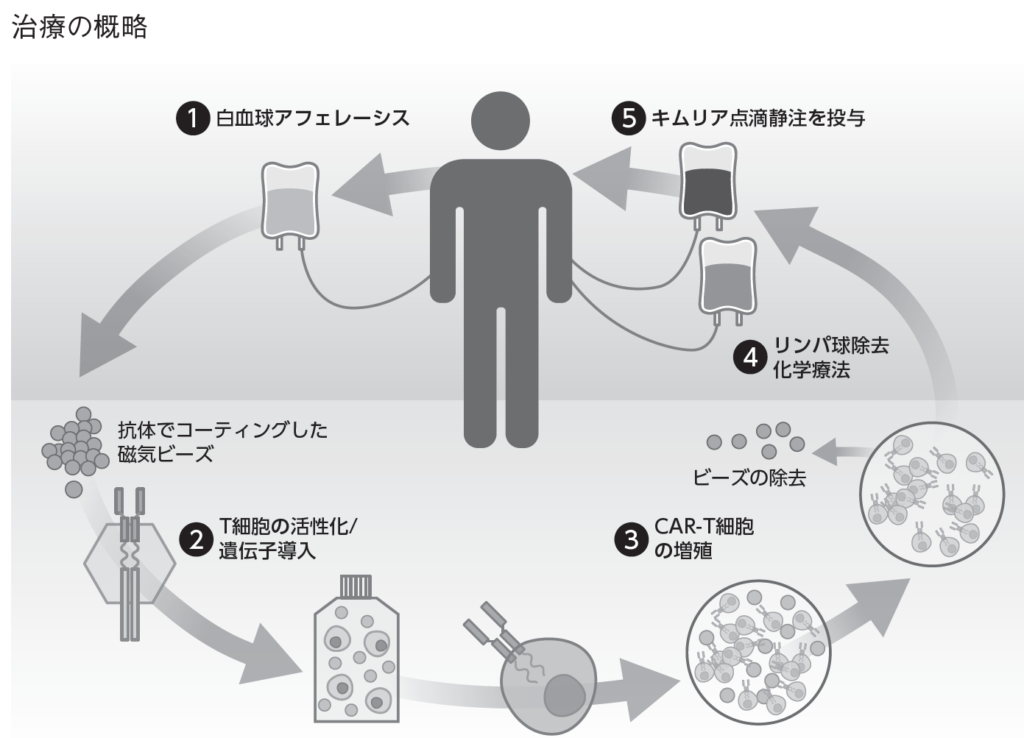
キムリアは自家T細胞製品であるため、まずアフェレーシス(体外循環による分離)により白血球(リンパ球・NK細胞・単球)を採取し、凍結状態で製造施設に送られます(上図①)。製造施設で解凍後、遠心分離によりT細胞を分離し、抗CD3/CD28抗体磁気ビーズで処理することで、T細胞の増殖活性を高めます。活性化させたT細胞にレンチウイルスによりCAR遺伝子を導入し、CAR-T細胞を作製します(上図②)。作製したCAR-T細胞を 抗CD3/CD28抗体磁気ビーズ存在下で十分に増殖させた後(上図③)、ビーズを除去し、結状態で医療機関に運ばれ、治療に用いられます。キムリアの投与前に、生体内でのCAR-T細胞の増殖と長期間にわたる持続性の促進を目的に、患者体内のリンパ球除去を行われた後に(上図④)、静脈点滴により投与されます(上図⑤)
現在、日本国内で治療を行う場合でも、アメリカ・ニュージャージー州の製造施設に患者白血球を輸送し、製造されています。日本では、神戸医療産業都市推進機構へ治験用製品製造の技術移転が完了しており、将来的に国内の製品製造とすることも検討されています。
【保険償還価格について】
キムリアの保険償還価格3349万3407円(消費税8%時)は、当時の薬価基準収載品の単価としては国内の史上最高額でした(2020年9月現在、ゾルゲンスマの1億6707万7222円が最高額となっています)。これは、製品原価(約2360万円)、利益(約410万円)や流通経費(約70万円)、消費税(約230万円)に加え、有用性加算と市場性加算(計約280万円)が計上され、決定されています(保険償還価格の算定資料)。
一方で、アメリカでの薬価は約47万5000ドル(2019年5月時のレートで約5200万円)です。しかしながら、アメリカでは成功報酬型が取られており、治療開始後1ヶ月で反応が見られた場合にのみ支払いが発生する仕組みとなっています。効果が見られない場合、費用は製薬会社の負担となってしまいますが、キムリアは臨床データ上8割の患者に効果があり、そのため成功報酬型でも成り立つようです。日本では、この成功報酬型の制度はなく従来の支払い制度が適用されたため、アメリカに比べ低額に抑えられたと考えられます。 再生医療等製品を含め、相次ぐ高額医薬品の登場に伴い、製薬企業側からも医薬品の成功報酬型制度を求める声が上がっています。成功報酬型制度の導入のためには医療制度の抜本的な改正が必要でありますが、厚生労働省としては「導入したいという企業がいれば検討しないでもない」というスタンスのようです。(参照元:日本経済新聞 2019年4月25日付 『成功報酬型の医薬品、日本は出遅れ』)
薬価の改訂
費用対効果評価制度により価格調整が行われ、2021年7月1日より3,264万7,761円へ引き下げとなっています。
