
〇便失禁,尿失禁疾患を対象とした自家骨格筋由来細胞製品の開発を行うベンチャー企業
〇切迫性便失禁を対象とする第3相国際共同治験が進行中(2023/10現在)
〇オーストリアのベンチャー企業を前身とし、日本での承認を目的に設立
【会社情報】
| 会社名 | イノバセル株式会社 Innovacell K.K. |
| 所在地 | 東京都渋谷区広尾5-22-3広尾西川ビル3階 |
| 代表者 | 代表取締役CEO ノビック・コーリン/Colin Lee Novick 代表取締役COO シーガー・/Jason David Sieger |
| 設立 | 2021年1月5日 |
| 上場 | 非上場 |
【会社概要】
便失禁,尿失禁疾患を対象とした再生医療等製品の開発を行うベンチャー企業です。同社はオーストリアのインスブルック医学大学発の再生医療ベンチャーであるInnovacell Biotechnologie社(現在はInnovacell GmbH)を前身とし、日本の再生医療等製品の早期承認制度(条件及び期限付き承認制度)に注目し、日本での承認取得および日本での株式上場を目的として日本で設立されました。
自家骨格筋由来細胞、もしくは自家骨格筋由来平滑筋細胞を用いた切迫性便失禁、漏出性便失禁、腹圧性尿失禁の3つのパイプラインの開発が進められており、切迫性便失禁については日本を含めた第3相国際共同治験が進行中です。
【事業内容】
便失禁、尿失禁疾患を対象とした再生医療
自家骨格筋由来細胞、もしくは自家骨格筋由来平滑筋細胞を用いた切迫性便失禁、漏出性便失禁、腹圧性尿失禁の3つのパイプラインの開発が進められています。
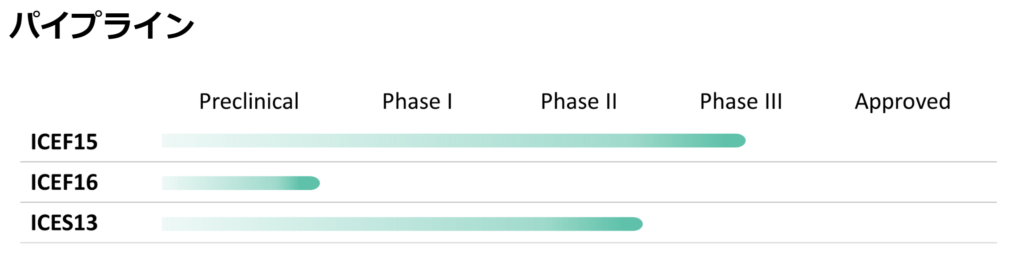
イノバセル社パイプライン (出典:イノバセル株式会社ウェブサイト)
ICEF15:切迫性便失禁を対象とする自家骨格筋由来細胞
切迫性便失禁は、突然の強い便意を感じるもののトイレまで我慢することができずに便を漏らしてしまう便失禁です。加齢による衰えや分娩時の傷害などにより外肛門括約筋の機能が低下することが原因で発症します。既存の治療法では、食生活の改善や下痢止め剤、肛門括約筋訓練などの保存的療法が行われますが、効果が見られない場合は肛門括約筋形成術など侵襲を伴う外科治療が必要となります。
そこで、患者自身の筋肉組織から筋衛星細胞を単離・培養して得られた骨格筋由来細胞を外肛門括約筋に局所投与することで外肛門括約筋の再生を促し、機能回復を図ります。
2023年10月現在、欧州(スペイン、ブルガリア、ドイツなど10ヵ国)および日本での第3相国際共同治験(第Ⅲ相無作為化、プラセボ対照、二重盲検2群間比較臨床試験)が進行中であり、2023年9月に日本での一例目の患者組み入れも行われています。
ICEF16:漏出性便失禁を対象とする自家骨格筋由来平滑筋細胞
漏出性便失禁は、便意を一切感じないにも関わらず自分の意思とは関係なく便が漏れる便失禁であり、便失禁の約半数を占めます。自分の意志で動かすことのできない不随意筋である内肛門括約筋が、加齢などにより機能低下を起こすことが原因です。既存の治療法では、食生活の改善や下痢止め剤、排便習慣指導、肛門括約筋訓練などの保存的療法が行われますが、効果が見られない場合は肛門括約筋形成術など侵襲を伴う外科治療が必要となります。
漏出性便失禁に対しては、平滑筋細胞移植により機能回復を図ります。平滑筋組織の採取は非常に難しいため、イノバセル社では骨格筋由来の前駆細胞から平滑筋細胞へ分化させる技術を確立し、動物実験により有効性を実証しています。
ICES13:腹圧性尿失禁を対象とする自家骨格筋由来細胞
腹圧性尿失禁は、重いものを持ち上げたり咳やくしゃみなどでお腹に力が入った際に尿が漏れてしまう尿失禁であり、主に尿道括約筋や骨盤底筋群が加齢により衰えたり分娩時に傷害を受けることで機能が低下することが原因です。既存の治療法では、薬物療法や骨盤底筋トレーニング、外科手術や医療機器の埋め込みなどが行われます。しかしながら、これらの治療法では効果が不十分であったり副作用が生じることもあり、長期的に効果のある根治的治療とはなりません。
そこで腹圧性尿失禁に対して、患者自身の骨格筋細胞を培養し、尿道括約筋に局所投与することで機能回復を図ります。
ICES13は欧州での第I相 と後期第II相試験にてエンドポイントを達成しています。
承認申請の方針
上述の通り、同社の設立当初は日本の早期承認制度/条件及び期限付き承認制度を目指す方針でした。しかしながら、早期承認制は非常に良い制度であるとした上で、有効性のエビデンスに基づいた通常承認を受けた製品の方が実際に使用する医師にとっても治療を受ける患者にとっても望ましいとの判断から、現在は通常承認を目指す方針としています。
特に再生医療が対象とすることの多い希少疾患では、通常承認で求められる症例数を集めるためには非常に時間がかかることがあり、新規治療を患者へ早期に届ける目的においては早期承認制度は有用であると考えられます。しかし、日経バイオテク「再生医療等製品の早期承認制度をどう使うか」の中では”「医療現場は本当に効くのかどうかを評価して使うかどうかを決める。早期承認を取得して大きく売れている製品はこれまでに無い。早ければいいというわけではなく、本当に効くかどうかが重要だ」”との意見が紹介されており、”一定の規模の臨床試験を実施して、明確な有効性のエビデンスを示し、医療現場に使ってもらうというのが、結局は一番の近道なのだという認識が広がりつつある”とされています。
早期承認制度が適用されるか、もしくは通常承認となるかは申請企業が決めるものではなく、申請データを基にPMDAが判断します。早期承認制度の制定時にNature誌にて指摘があったように、PMDAには早期承認を適用した再生医療等製品について市販後の検証を厳格に行い、有効な製品のみが医薬品として患者に届くことを保証し、早期承認制度が有用に働く制度であることを示すことが求められます。
