
| 販売名 | アベクマ®点滴静注 |
| 一般的名称 | リソカブタゲン マラルユーセル |
| 製造販売者 | ブリストル・マイヤーズ スクイブ株式会社 |
| 対象疾患 (承認日/保険収載日) | 再発又は難治性の多発性骨髄腫。ただし、以下のいずれも満たす場合に限る。 ・BCMA抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない ・免疫調節薬、プロテアソーム阻害剤及び抗CD38モノクローナル抗体製剤を含む2つ以上の前治療歴を有し、かつ、直近の前治療に対して病勢進行が認められた又は治療後に再 発した |
| 承認日/保険収載日 | 2022年1月20日/2022年4月20日 |
| 保険償還価格 | 3264万7761円 (保険償還価格の算定) |
| 関連文書 | 添付文書 (PMDAウェブサイト) 審査報告書 (PMDAウェブサイト) 申請資料概要 (PMDAウェブサイト) |
【製品概要】
アベクマ®点滴静注(以下、アベクマ)は、再発または難治性の多発性骨髄腫を対象とする再生医療等製品です。日本ではキムリア、イエスカルタ、ブレヤンジに続く4品目のCAR-T製品となりますが、それらがいずれもCD19抗原を標的とするB細胞リンパ腫の治療薬であるのに対して、アベクマはBCMA抗原を標的とする多発性骨髄腫の治療薬です。国際共同第II相臨床試験では、全奏効率(部分奏功以上の割合)が73.4%、完全奏功率が31.3%の効果が得られています。
薬価は前述のCAR-T製品と同じく1患者当たり3264万7761円と設定されており、保険償還価格の算定における市場規模予測では、ピーク時(販売開始後10年目)の使用患者数149人、販売金額49億円と予測されています。
製品名はBCMAをターゲットにしていることから、”Anti BCMA”に由来しています。
【対象疾患と作用メカニズム】
対象疾患
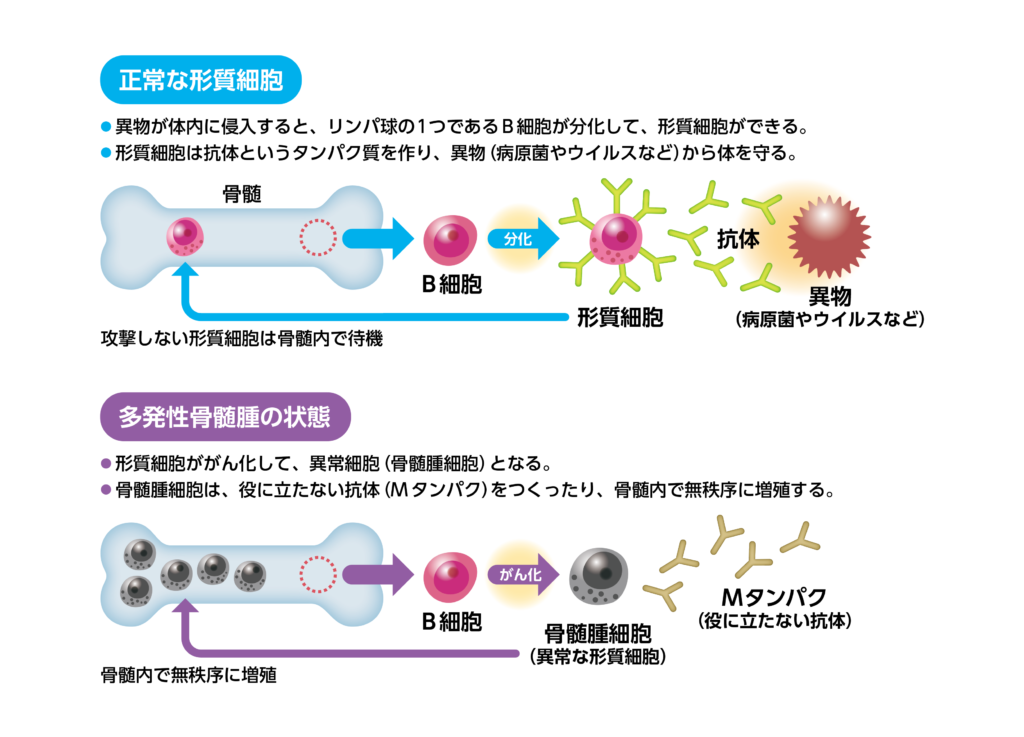
再発又は難治性の多発性骨髄腫が対象です。多発性骨髄腫は⾎液細胞の⼀種である形質細胞ががん化することによって起こる血液がんです。リンパ球のひとつであるB細胞は異物を認識すると形質細胞へと変化し、抗体を産生することで免疫反応を起こし、異物から体を守ります。この形質細胞ががん化し、骨髄中で無秩序に増殖した結果、異常抗体(Mタンパク)の蓄積による免疫力の低下や腎不全、造血機能の低下による貧血、骨の代謝バランスの崩壊による骨破壊、高カルシウム血症などが起こります。
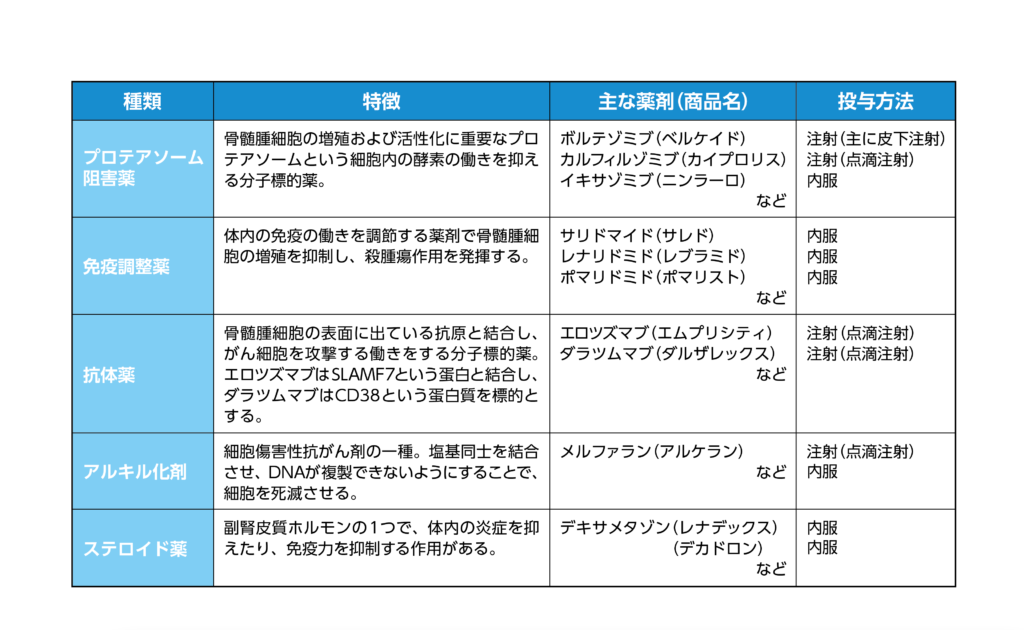
多発性骨髄腫の標準治療では、下表のような様々な対応の薬剤を併用する薬物療法を行います。これらの治療の結果、効果が見られなかったもしくは再発した、「免疫調節剤、プロテアソーム阻害剤、抗CD38モノクローナル抗体を含む2つ以上の前治療歴を有する再発又は難治性の多発性骨髄腫」がアベクマの対象となります(承認申請時には「3つ以上の前治療歴」でしたが、適応追加により「2つ以上の前治療歴」に変更)。
構造および作用メカニズム

アベクマはCAR-T技術を応用した抗がん細胞製品であり、抗BCMAキメラ抗原受容体(Chimeric Antigen Receptor:CAR)を患者自身のT細胞に発現させた抗BCMA CAR T細胞です。
BCMA(B細胞成熟抗原; B–cell maturation antigen)は多発性骨髄腫患者の形質細胞や骨髄腫細胞には発現していますが、正常非造血組織には発現が見られない抗原です。抗原認識部位でBCMAを選択的に認識し結合すると、各ドメインを介してシグナルが伝達されることでCAR-T細胞が活性化します。活性化したCAR-T細胞はBCMA発現細胞に対して細胞傷害活性を発揮するとともに、同時に自己増殖を起こすことで抗腫瘍活性を増強および持続することができます。

【製造および治療の流れ】

アベクマは患者自身のT細胞から製造されるため、まず白血球アフェレーシス(体外循環による分離)により患者のT細胞を採取します。採取されたT細胞は米国の細胞製造施設に送られ、CAR遺伝子の導入等の加工が行われた後に、-130℃以下の凍結状態で医療機関に送られ投与されます。アフェレーシスから投与までの期間は平均して40日間です。
【臨床成績】
アベクマは日本からの参加も含む国際共同第2相試験の結果を基に申請が行われました。主要評価項目である全奏効率(ORR; 部分奏効率以上の割合)は73.4%(日本人では88.9%)、その内完全奏功率(CRR)は31.3%(日本人では55.6%)でした。
国際共同第Ⅱ相試験 (BB2121-MM-001試験/KarMMa試験)
| 試験デザイン | オープンラベル、単群、多施設共同、第Ⅱ相試験 |
| 対象 | 再発及び難治性の多発性骨髄腫患者 |
| 対象患者数 | 137例 (内 日本人9例) |
| 主要評価項目 | 全奏効割合 (ORR): 国際骨髄腫ワーキンググループの多発性骨髄腫の 統一効果判定基準に基づく |
試験結果
| 外国人(128例) | ORR: 73.4% (300×106個投与: 68.6%,450×106個投与: 81.5%) 完全奏功率(CRR): 31.3% (300×106個投与: 28.6%,450×106個投与: 35.2%) |
| 日本人(9例) | ORR: 88.9% (全例450×106個投与) CRR: 55.6% |
