2024/8/2 新生児低酸素性虚血性脳症に対する適応拡大開発中止について追記

| 販売名 | テムセル®HS注 |
| 一般的名称 | ヒト(同種)骨髄由来間葉系幹細胞 |
| 製造販売者 | JCRファーマ株式会社 |
| 対象疾患 | 造血幹細胞移植後の急性移植片対宿主病(GVHD) |
| 承認日/保険収載日 | 2015年9月18日 / 2015年11月26日 |
| 保険償還価格 | 86万8680円/バッグ(72×106細胞) |
| 関連文書 | 添付文書 (PMDAウェブサイト) 審査報告書 (PMDAウェブサイト) 申請資料概要 (PMDAウェブサイト) |
【製品概要】
JCRファーマ社によるテムセル®HS注サイト
他家骨髄から採取・培養した間葉系幹細胞(MSC)製剤です。造血幹細胞移植(骨髄移植、末梢血幹細胞移植、臍帯血移植)後の合併症である、急性移植片対宿主病(GVHD)が適用対象となります。JCRファーマ社が、2003年に米Osiris Therapeutics社から技術導入し、開発した製品です。細胞源であるヒト骨髄を米国から輸入し、日本国内で培養・製造しています。製品名の由来は、間葉系幹細胞の英名であるmesenchymal stem cellの一部(語尾)です。
2019年3月期の売上高は20億4100万円となっています(JCRファーマ株式会社2019年3月期 決算概要)。薬価から算出した推定販売バッグ数は2,350バッグです。1回あたり投与量が、患者体重1kgあたり2×106細胞であり、標準的治療では8回投与を行います(症状に応じて、12回まで投与可能)。したがって、体重36kg以上の患者に対しては、1回の治療に標準的には16バッグ使用されます。このことから、推定適用患者数は約147人となります。また、2020年3月期では、前年比54.5%プラスの28億円の売上が予想されています(JCRファーマ株式会社2020年3月期 第2四半期決算説明会 決算概要)。
【対象疾患】
急性移植片対宿主病(GVHD)
造血幹細胞移植後の合併症である、急性移植片対宿主病(GVHD; Graft-versus-Host Disease)のうち、ステロイド療法によっても十分な治療効果が得られない症例に適用されます。白血病等の治療として骨髄移植などの造血幹細胞移植が行われますが、ドナー由来白血球が患者組織を異物とみなして免疫的に攻撃する疾患がGVHDです。
急性GVHDは、一般的に移植後6-30日頃に発症し、主に皮膚、消化管、肝臓に障害が起こります(ただし、100日後以降に発症する遅発型急性GVHDもあります)。発症メカニズムについてはまだ不明な点も多いですが、ドナーより採取した造血幹細胞中に混じった白血球が原因とされます。一方で、慢性GVHDは移植後100日以降に発症することが多く、皮膚、消化管、肝臓以外にも、肺や筋肉、眼球、頭皮(脱毛)等、多組織に障害を生じます。生着した造血幹細胞から生じた白血球による免疫的攻撃が原因とされています。ただし、移植後100日前に発症することもあり、単純に移植後の日数ではなく症状により急性と慢性は区別されます。
急性GVHDを発症した場合、1次治療としてステロイド投与による免疫抑制療法が行われます。テムセル®HS注は、ステロイド治療の効果が見られなかった患者に対する2次治療として適用されます。
【作用メカニズム】

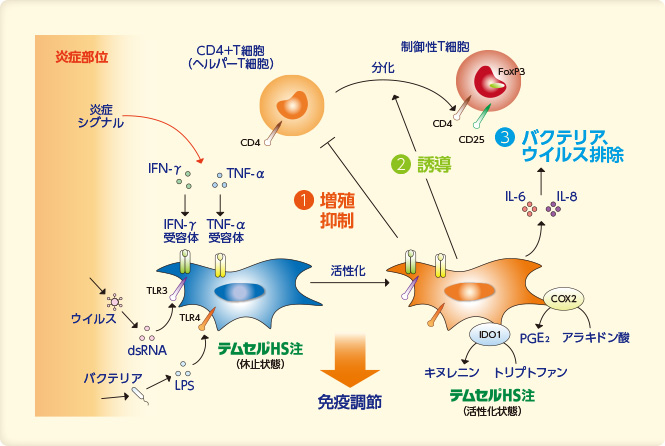
投与されたテムセル®HS注(=間葉系幹細胞)は、TNF-αといった炎症性サイトカインやIGF-1, PDGF-BBといった成長因子等により刺激され、炎症部位に誘引、活性化されます。その後、血管内皮細胞上のP-セレクチン等と結合し、MMP2, MMp14, TIMP2といったマトリクス分解酵素の働きにより血管外へ遊走し、炎症部位に浸潤します。
炎症部位に遊走したテムセル®HS注は、IFN-γやTNF-αといった炎症性サイトカインなどによって活性化されたのち、CD4+T細胞(ヘルパーT細胞)の抑制や制御性T細胞への分化を誘導することで炎症部位での免疫反応を抑制し、GVHDの症状を改善します。
【適応拡大開発状況】
適応拡大として、表皮水疱症および新生児低酸素性虚血性脳症の開発が進められています。 表皮水疱症については、適応拡大の承認申請を行っていましたが、有効性をより明確に示す必要性を理由に、2019年9月に一旦申請を取り下げています。
新生児低酸素性虚血性脳症については、第I/II相臨床試験において有効性を示すことができなかったことから開発中止となっています。
【類似の開発品】
テムセル®HS注と同じく、GVHDを対象とした間葉系細胞治療製品が開発されています。
1. iPS細胞由来間葉系幹細胞(富士フィルム社)
富士フィルム社が、オーストラリアの再生医療ベンチャーであるCynata Therapeutics社から導入した、他家iPS細胞由来間葉系幹細胞です。2020年中に治験の開始が計画されています。
2. 臍帯由来間葉系細胞(東京大学医科学研究所/ヒューマンライフコード社)
東京大学医科学研究所で開発が進められている、臍帯由来間葉系細胞です。現在、第I相医師主導治験が進行中です。その後は、ヒューマンライフコード社により企業治験が計画されています。
3. 羊膜由来間葉系幹細胞(兵庫医科大学/北海道大学)
兵庫医科大学と北海道大学が開発を進める羊膜由来間葉系幹細胞です。2017年にGVHDとクローン病を対象とした第I/II相医師主導治験の治験届が提出され、進められています。
