
| 販売名 | Tecartus® |
| 一般的名称 | brexucabtagene autoleucel |
| 製造販売者 | Kite Pharma, Inc |
| 対象疾患 | ・再発性または難治性のマントル細胞リンパ腫(MCL)の成人患者 (Adult patients with relapsed or refractory mantle cell lymphoma (MCL)) ・再発または難治性のB細胞前駆細胞急性リンパ性白血病(ALL)の成人患者 (Adult patients with relapsed or refractory B-cell precursor acute lymphoblastic leukemia (ALL)) |
| 承認日/保険収載日 | 2020年7月24日 (MCL) 2021年10月1日 (ALL) |
| 薬価 | $373,000 (≒3991万1000円) 1$=107円(2020年7月当時) |
| 関連文書 | 添付文書 (Package Insert and Medication Guide) 審査資料 (Summary Basis for Regulatory Action) |
【製品概要】
Kite Pharma社 患者向けサイト TECARTUS Website
Kite Pharma社 医療機関向けサイト TECARTUS HCP Website
Tecartusは再発性または難治性のマントル細胞リンパ腫(MCL)および再発または難治性の B 細胞前駆細胞急性リンパ性白血病(ALL)を対象とするCD-19標的CAR-T細胞製品であり、2020年7月に米Kite Pharma社が迅速承認として承認を取得しました。同じくKite Pharma社が開発したCD-19標的CAR-T細胞製品であるイエスカルタと同じ構造のCARが使用されていますが、イエスカルタとは製造工程が異なります。
臨床試験では、MCLを対象とした臨床試験(ZUMA-2試験)において客観的奏効率(ORR; 完全奏功+部分奏功) 87%、ALLを対象とした臨床試験(ZUMA-3試験)において全完全奏功率65%の成績が得られています。2023年5月の段階で臨床試験、市販製品合わせて2300件以上の治療実績があります。
2024年5月現在日本では未承認ですが、MCLおよびALLを対象とした治験が進められています(PMDA 主たる治験情報リスト 治験識別記号:KTE-X19)。
【対象疾患】
再発性または難治性のマントル細胞リンパ腫
マントル細胞リンパ腫(MCL)は悪性リンパ腫の1つであり、リンパ節濾胞の外縁部(マントル層)を構成するB細胞が悪性形質転換することによって生じる中悪性度(月単位で病気が進行)に分類される非ホジキンリンパ腫です。60歳代半ばで発病することが多く、女性よりも男性に多い病気です。アメリカでは非ホジキンリンパ腫の約6%を占め、患者数は約4200人程度とされています(Mantle Cell Lymphoma Facts)。(日本では2000人程度)
進行期の一般的な治療法としてはリツキサン®(リツキシマブ,抗CD20抗体医薬)と化学療法の併用が行われ、効果が見られない場合(難治性)や寛解後に再発した場合(再発性)には放射線療法や造血幹細胞移植といった治療が行われます。このような難治性、再発性のMCLがTecartusの対象となります。
再発または難治性のB細胞前駆細胞急性リンパ性白血病
急性リンパ性白血病(ALL)は骨髄中のリンパ芽球が悪性形質転換することで引き起こされる急性白血病であり、B細胞前駆細胞型はそのうちの約85%を占めます。小児~思春期に発症することが多く、発症のピークは2-5歳です。加齢とともに発症率は減少し成人での発症は10万人に1人程度と稀ですが、発症率は50歳前後に増加する傾向があります。
成人B細胞ALLではビーリンサイト®(ブリナツモマブ,抗CD3/CD19二重抗体医薬)やベスポンサ®(イノツズマブオゾガマイシン,抗CD22抗体/オゾガマイシンの複合体)などによる治療が行われますが、これらの治療で効果が見られなかった難治性や再発性の成人B細胞ALLがTecartusの対象となります。
【構造とメカニズム】

Tecartusは抗CD19キメラ抗原受容体(Chimeric Antigen Receptor:CAR)を患者自身のT細胞に発現させたCD19標的CAR-T細胞製品です。CARの構造は同じくKite Pharma社が開発したイエスカルタと同一です。
CARがB細胞表面に発現するCD19を認識し結合することでCARを通じてシグナルが入り、T細胞の増殖、活性化を促進します。活性化したT細胞は炎症性サイトカインやケモカインを放出することでCD19を発現しているB細胞を破壊します。一方で、この時に放出される炎症性サイトカインによるサイトカイン放出症候群(cytokine release syndrome: CRS)がTecartusに限らずCAR-T細胞療法における重大な副作用として問題になっています。
【製造および治療の流れ】
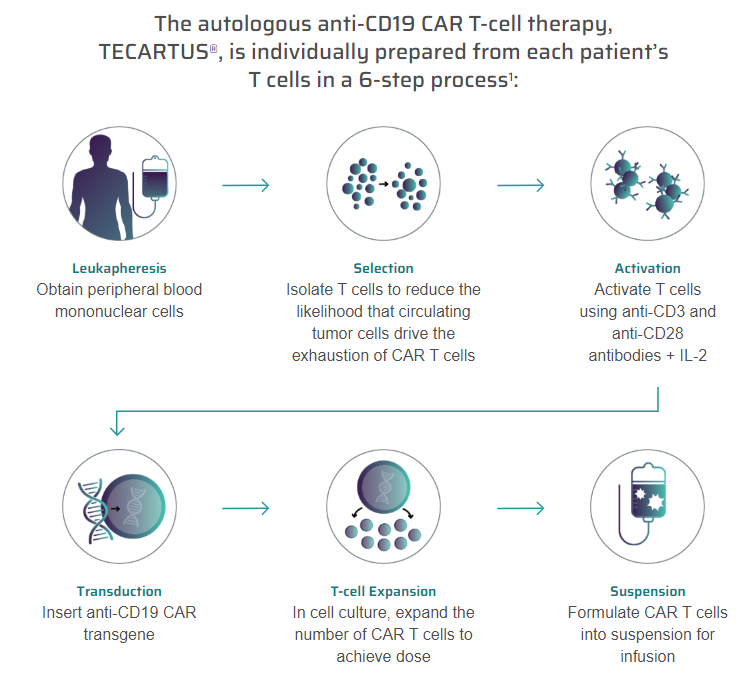
Tecartusは患者自身のT細胞から製造される自家細胞製品のため、まず白血球アフェレーシス(体外循環による分離)により患者のT細胞を採取します。採取されたT細胞はKite Pharma社の製造施設に送られ、CAR遺伝子の導入および増殖培養後に医療機関に搬送されます。
Tecartusの製造工程では、XLPTMプロセスと呼ばれるT細胞の選択的濃縮ステップが追加されています(上記図中「Selection」のステップ)。白血球アフェレーシスにより採取した患者検体中にはがん化B細胞が混入しており、CD19遺伝子導入後の製造工程において製造したCAR-T細胞とこれらのがん化B細胞と反応することで不必要なCAR-T細胞の活性化が起こり、品質に悪影響が生じます。このXLPプロセスがTecartusの特徴であり、イエスカルタと異なる点となっています。

Tecartusの平均製造日数は15日、成功率は96%となっています。平均製造日数は、同じくCD19標的CAR-T製品であるイエスカルタの17日、ブレヤンジの24日と比較して短期間であり、月単位で病気が進行するMCLやALLにとっては大きな利点となります。
【臨床成績】
TecartusはMCLを対象とした第II相試験(ZUMA-2試験)の結果を基に迅速承認、ALLを対象とした第II相試験(ZUMA-3試験)により適用拡大をそれぞれ取得しています(※ZUMA試験はKite Pharma社によって実施される主にCAR-T療法の有効性と安全性を評価する一連の臨床試験の呼称です)。
MCL/ZUMA-2試験では全奏効率(ORR; 完全奏功+部分奏功)が主要評価項目として設定され、投与された68例でのORRは87%でした。ALL/ZUMA-3試験では全完全奏功率(完全奏功(CR)+不完全な血液学的回復を伴う完全奏功CRi)が主要評価項目であり、投与された55例(評価対象は54例)での全完全奏功率は65%でした。
MCL:第Ⅱ相試験 (ZUMA-2試験)
| 試験デザイン | 第II相、多施設、非盲検、単群(非対照) |
| 対象 | 再発性または難治性のマントル細胞リンパ腫の成人患者 |
| 実施国 | 米国 |
| 対象患者数 | 登録:74例、投与:68例 |
| 主要評価項目 | 全奏効割合 (ORR; 完全奏功(CR)+部分奏功(PR)) |
試験結果
| 有効性評価 | ORR: 87% (CR: 62% + PR: 25%) |
B細胞ALL:第Ⅱ相試験 (ZUMA-3試験)
| 試験デザイン | 第II相、多施設、単群(非対照) |
| 対象 | 再発または難治性のB細胞前駆細胞急性リンパ性白血病の成人患者 |
| 実施国 | 米国 |
| 対象患者数 | 登録:71例、投与:55例(評価対象は54例) |
| 主要評価項目 | 全完全奏功率 (完全奏功(CR)および不完全な血液学的回復を伴う完全奏功CRi) |
試験結果
| 有効性評価 | 全完全奏功率: 65% (CR: 52% + CRi: 13%) |
