
| 販売名 | アロフィセル®注 |
| 一般的名称 | ダルバドストロセル |
| 製造販売者 | 武田薬品工業株式会社 |
| 対象疾患 | 非活動期又は軽症の活動期クローン病患者における複雑痔瘻 |
| 承認日/保険収載日 | 2021年9月27日/2021年11月25日 |
| 保険償還価格 | 4瓶1組 5,620,004円 (保険償還価格の算定) |
| 関連文書 | 添付文書 (PMDAウェブサイト) 審査報告書 (PMDAウェブサイト) 申請資料概要 (PMDAウェブサイト) |
【製品概要】
武田薬品工業株式会社 アロフィセル.jp
アロフィセル®注(以下、アロフィセル)は、クローン病患者の複雑痔瘻を対象とする他家脂肪組織由来幹細胞製品です。ベルギーTiGenix社が開発し、2016年に米国以外の権利が武田薬品にライセンスアウトされています(その後、TiGenix社は2018年に武田薬品に買収)。
薬価は1回量(4瓶1組)あたり562万4円であり、保険償還価格の算定https://www.mhlw.go.jp/content/12404000/000855557.pdfにおける市場規模予測では、ピーク時(2028年度予測)の患者数920人、販売金額52億円と予測されています。欧州では2018年3月に承認を受けており、2023年10月現在でEU、イスラエル、スイス、セルビア、英国において承認を取得しています。
製品名(販売名)の由来は、「Allogenic (他家) + Fistula (瘻孔) + Cell (細胞)」の組み合わせです。
【対象疾患と作用メカニズム】
対象疾患
既存治療薬による治療の効果が不十分な非活動期又は軽症の活動期クローン病患者における複雑痔瘻が対象となります。
クローン病は消化管粘膜に原因不明の炎症が起こる疾患であり、主に腹痛、下痢、体重減少、発熱などの症状が見られ、症状が落ち着く寛解期と悪化する活動期を繰り返すことが特徴です。直腸から肛門部分で炎症および潰瘍形成が繰り返された結果、直腸部に穴(瘻孔)が開き体外部まで貫通した状態が痔瘻です。痔瘻のうち、1つの原発口(直腸側の瘻孔)から複数の二次口(お尻側の瘻孔)ができている場合や、膿瘍が見られる場合を複雑痔瘻と呼びます。
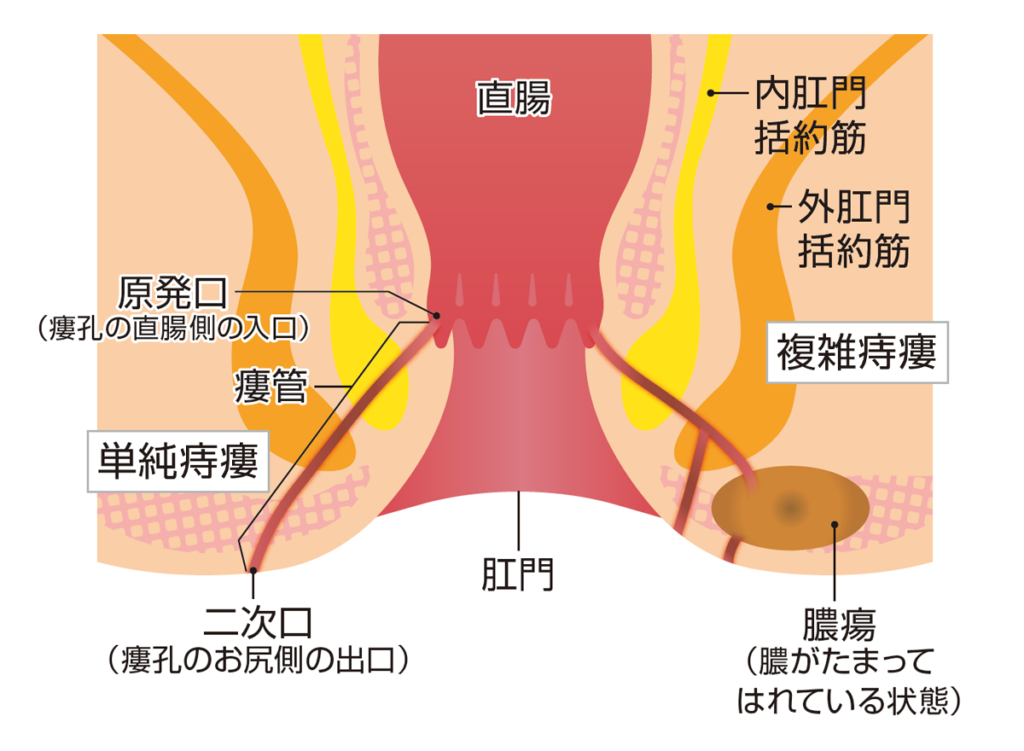
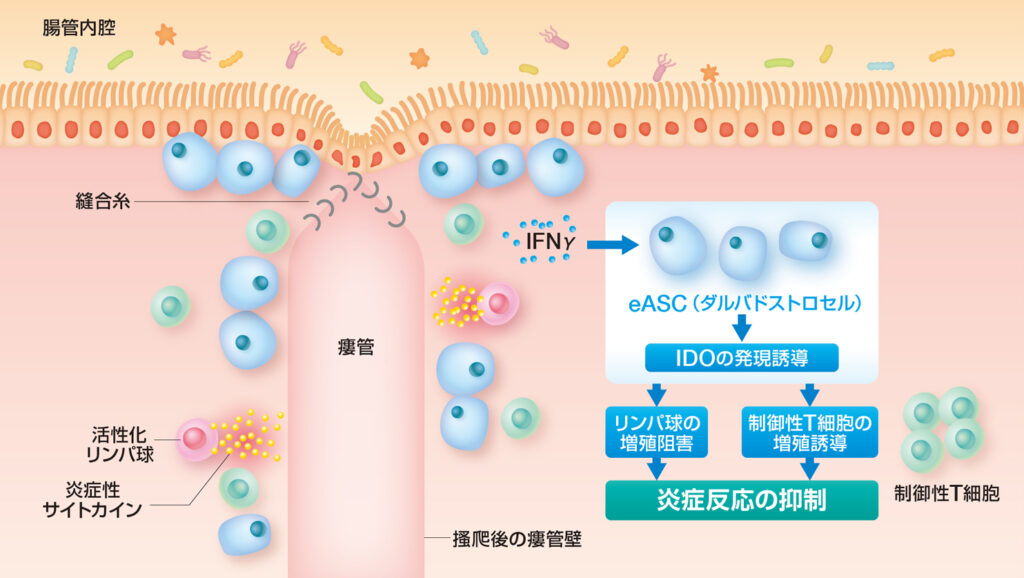
作用メカニズム
痔瘻では、細菌感染や排泄物などの付着により慢性的な炎症が生じ、炎症部位では活性化リンパ球が浸潤し、炎症性サイトカインが放出されています。

アロフィセルは炎症部位において活性化され、IDOの発現および免疫反応を抑制する制御性T細胞(Treg)の増殖の誘導により炎症反応を抑制することで、瘻孔周囲の組織の治癒を促進します。
【製造および治療の流れ】
アロフィセルの製造は、スペインの細胞製造施設にて脂肪組織より細胞を抽出し中間製品として製造した後、武田薬品工業の国内細胞製造施設(大阪工場)に搬送し、製造されます。
製造後は凍結状態ではなく15-22℃の温度管理下にて医療機関に搬送されます。そのため使用期限は製造後72時間と凍結製品と比較して短く、そのため他家細胞製品ではありますが受注生産となります。
瘻孔の排膿処置を行った後に各瘻孔の瘻管壁内へアロフィセル1回量(4瓶)を注射投与します。
【国外における承認状況】
アロフィセルは2018年に欧州で承認され、2023年10月現在、国外ではEU、イスラエル、スイス、セルビア、英国において承認を取得しています。
米国での承認申請に向けて第3相治験が進められていましたが、しかしながら2023年10月に主要評価項目(24週後の複合寛解率)を達成できなかったことが発表されています。
