
〇慢性脳梗塞を対象とした、自家骨髄由来間葉系細胞製品の開発を行う北大発ベンチャー
〇脳内移植用針、コンパニオン診断、脳内投与部位決定ソフトウェア、細胞輸送法といった周辺技術も開発
〇脳出血、脊髄損傷に対する治療法についても基礎研究が進行中
【会社情報】
| 会社名 | 株式会社RAINBOW RAINBOW,Inc. |
| 所在地 | 札幌市北区北21条西12丁目2 北大ビジネス・スプリング206号室 |
| 代表者 | 代表取締役 高橋悠一 |
| 設立 | 2019年8月9日 |
| 上場 | 非上場 |
【会社概要】
自家骨髄間葉系幹細胞(MSC)による脳梗塞の治療開発を行う、北海道大学発ベンチャーです。現在、亜急性期を対象とした医師主導第I相臨床試験が北海道大学病院で進行中です(2020年秋終了予定)。その後、慢性期脳梗塞を対象としたRAINBOW社主導の第II相企業治験が、2022年度中に計画されています。
北海道大学医学部脳神経外科で臨床への橋渡し研究として行われていたRAINBOW Projectの社会実装を目的に設立されたことが、社名の由来となっています。
【事業内容】
コア技術:自家骨髄MSC製品 HUNS001
RAINBOW社では、自家骨髄間葉系幹細胞(MSC)製品(HUNS001)を用いた脳・中枢神経疾患の治療開発が進められています。
①脳梗塞
脳血管疾患(脳卒中)は、脳内の血管が詰まったり破れて出血することで脳に障害が起こる疾患で、国内で年間約11万人が亡くなっており、がん、心疾患に続く第3位(10.8%)の死因となっています。また、救命された場合でも重篤な後遺症が残ることが多く、寝たきりの原因の第1位(36.6%)を占めています。
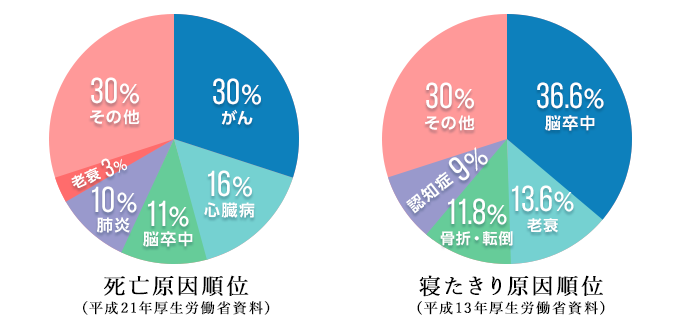
脳血管疾患の内、脳の血管が詰まることにより引き起こされる疾患が脳梗塞であり、脳血管疾患の死亡者の約6割を占めています。
北海道大学医学部脳神経外科では、自家骨髄由来MSC 製品HUNS001の投与による脳梗塞治療の開発が進められており、現在、医師主導第I相臨床試験が進行中です。HUNS001は自家細胞であることから脳内での長期生着が期待され、第I相臨床試験では移植2年後においても脳損傷部周辺に移植細胞の生着が見られています。
RAINBOW社は北海道大学からHUNS001のライセンス供与を受け、2022年に企業治験として第II相臨床試験の実施を計画しています。第I相試験では亜急性期脳梗塞を対象としていますが、第II相試験では慢性期脳梗塞を対象とすることを計画しています。
脳梗塞を対象としたMSC製品は、ニプロ/札幌医大(開発コード:STR01)、サンバイオ(開発コード:SB623)、ヘリオス/米アサシス(開発コード:MultiStem)、帝人/JCRファーマ(開発コード:JTR-161)、またMuse細胞製品として生命科学インスティテュート/東北大(開発コード:CL2020)の開発が進められています。これらは骨髄由来細胞MSCを用いた脳梗塞を対象とした細胞製品ですが、細胞源(自家/他家)、投与方法(静脈注射投与/脳内直接投与)、対象脳梗塞(急性/亜急性/慢性)が異なります。

また、図中のほかに、NCメディカルリサーチ社でも急性期脳梗塞を対象とした骨髄由来MSC製品の開発が進められています。
②脳出血
脳血管疾患の死亡者の約3割を占める脳出血に対する治療法の開発も、並行して進められています。こちらは慢性期を対象とした第I相臨床試験が2022年より計画されており、それに向けた基礎研究が進行中です。
③脊髄損傷
脊髄損傷の治療開発も進められています。こちらは細胞シート等をh利用した投与が検討されており、現在、基礎研究が進められています。
周辺技術
RAINBOW社では、製品の品質や治療の効果を高めるため、以下のような周辺技術の開発を進めています。
①ヒト血小板溶解物を用いた新規培養法
多くの細胞では培養時に生体由来物質の添加を必要とし、通常牛胎児血清(FBS)が使われます。しかしながら、臨床に用いる細胞の培養に対して動物由来成分を用いるのは、安全性の面から好ましくなく、そこでRAINBOW社ではFBSの代わりにヒト血小板溶解物、さらに新規培養添加物を併用する培養方法を開発しています。第I相臨床試験では他家血小板溶解物が使われましたが、第II相臨床試験では全身状態の安定した慢性期脳梗塞患者が対象のため、自家の血小板溶解物が使われます。
②新規細胞輸送法
RAINBOW社では、製品の供給体制として各地域の大学病院と連携したセントラルCPC方式を計画しています。
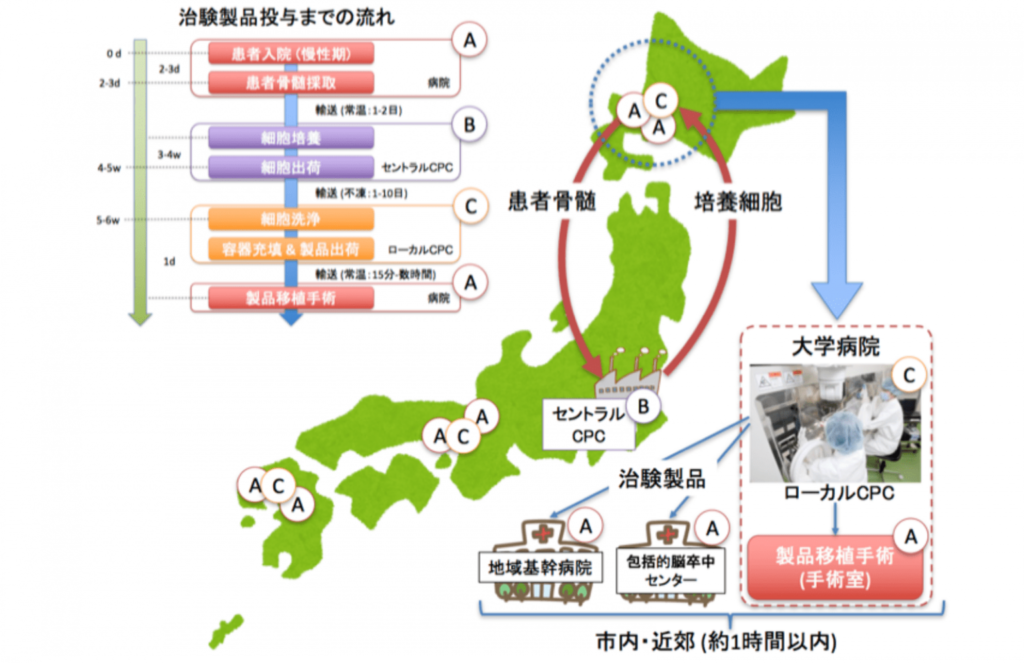
医療機関(図中Ⓐ)で採取された患者骨髄は、セントラルCPCと呼ばれる培養施設(図中Ⓑ)に送られ、間葉系細胞を抽出・培養します。細胞培養終了後、医療機関の地域にある培養施設を持つ大学病院(図中Ⓒ)に送られ、そこで洗浄・包装され、治療を行う医療機関へと送られる体制となっています。細胞輸送の際に問題となる細胞生存率の低下を改善するために、高い細胞生存率を保つ独自の細胞輸送法を開発しています。
③脳MRIによる細胞移植前評価法
細胞移植前の脳の損傷程度によって治療効果に影響が見られることが、第I相臨床試験において明らかになっています。そこで第II相臨床試験では、移植前の脳MRIにより損傷を評価することで、治療効果が高いと予測される症例を選別するコンパニオン診断が計画されています。
④新規移植針
脳内への直接投与では、脳組織を傷つける潜在的なリスクがあります。そこで、従来の移植針に比べて脳内へ安全に移植できる移植針を開発しており、特許出願しています。
⑤脳内移植部位最適化のための新規ソフトウェア
経口投与や静脈注射と違いHUNS001は脳内に直接投与することから、その投与部位が治療効果に大きく影響します。しかし、最適な部位は患者により異なり、その見極めは施術する医師の経験にも左右されます。そこで、第I相臨床試験の結果をもとに、客観的に最適な投与部位を決定するソフトウェアを開発中です。
