
| 販売名 | ビズノバ® |
| 一般的名称 | ネルテペンドセル |
| 製造販売者 | 合同会社オーリオンバイオテック・ジャパン |
| 対象疾患 | 水疱性角膜症 |
| 承認日/保険収載日 | 2023年3月17日/2024年9月1日 |
| 保険償還価格 | 9,464,500円 (医療機器の保険適用について) |
| 関連文書 | 添付文書 (PMDAウェブサイト) 審査報告書 (PMDAウェブサイト) 申請資料概要 (PMDAウェブサイト) インタビューフォーム |
【製品概要】
合同会社オーリオンバイオテック・ジャパン ビズノバ 製品情報サイト

ビズノバは水疱性角膜症を対象とする他家培養ヒト角膜内皮細胞製品です。京都府立医科大学の木下茂 教授らのグループの研究開発および医師主導治験の結果を基に、米Aurion Biotech社の日本法人であるオーリオンバイオテック・ジャパン社が製造販売承認を取得しています。
第3相治験での有効性評価では、全例(12例中12例)で主要評価項目(移植後24週における角膜内皮細胞密度1000個/mm2 以上)を達成しています。
保険償還価格(薬価)は9,464,500円、市場規模予測ではピーク時(2029年度/販売6年目予測)の患者数は160人とされています。
製品名はvis(ラテン語の語幹で「視力」)、nova(ラテン語で「新しい」)に由来しています。
【対象疾患】
水疱性角膜症は角膜の角膜内皮細胞の脱落・減少により角膜の不透明化が起こり、極端に視力が低下する疾患です。
角膜は眼の一番外側の膜であり、眼に入ってくる光を網膜上に焦点を合わせるための強い屈折力をもち、いわゆるレンズの役割をしています。角膜は5つの層から構成され、角膜内の水分量を一定に保つことで透明性を維持しています。角膜内皮細胞は角膜の一番内側に存在する細胞で、角膜内の水分を排出するポンプ機能をもつ細胞です。角膜内に余分な水分が溜まると浮腫や混濁が起こり、角膜の不透明化が生じますが、角膜内皮細胞が角膜内の水分量を適切に調節することで角膜の透明性が維持されています。
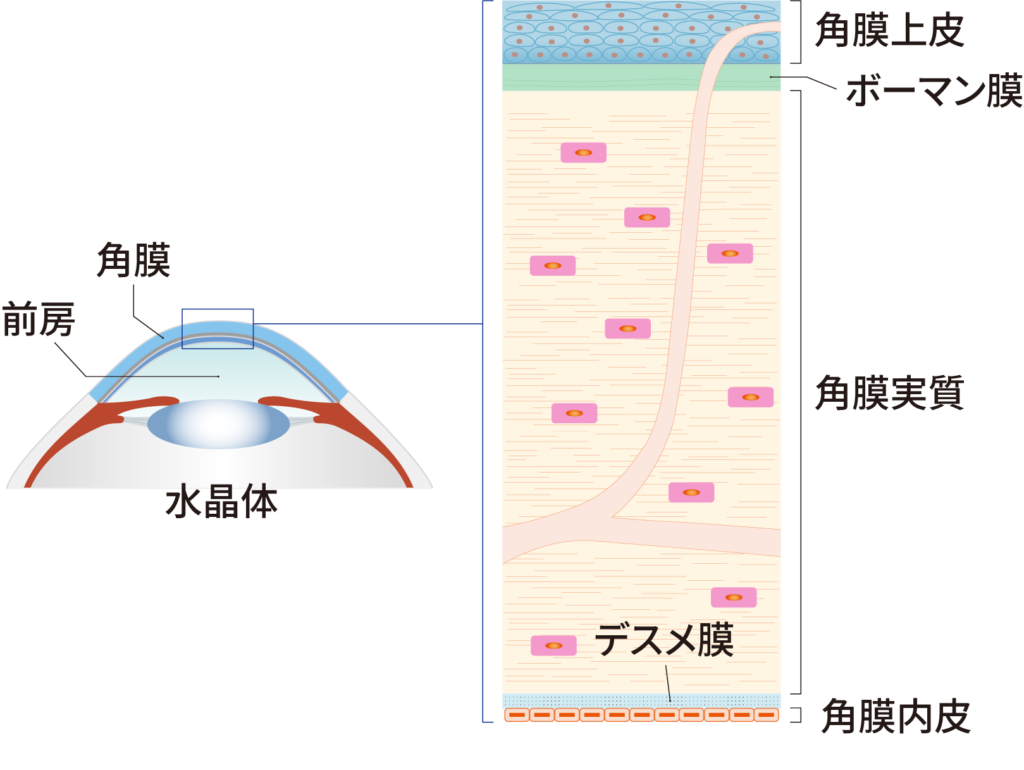
角膜内皮細胞は細胞分裂をしないため、加齢や外傷等により細胞数が減少した場合、残存する角膜内皮細胞が移動、伸展することで補完し、機能を維持します。しかしながら細胞密度が500個/mm2未満になった場合、水分量調節機能を十分に維持することができず、角膜の不透明化による極端な視力低下が起こります。この病態が水疱性角膜症であり、進行すると失明に至る危険もあります。
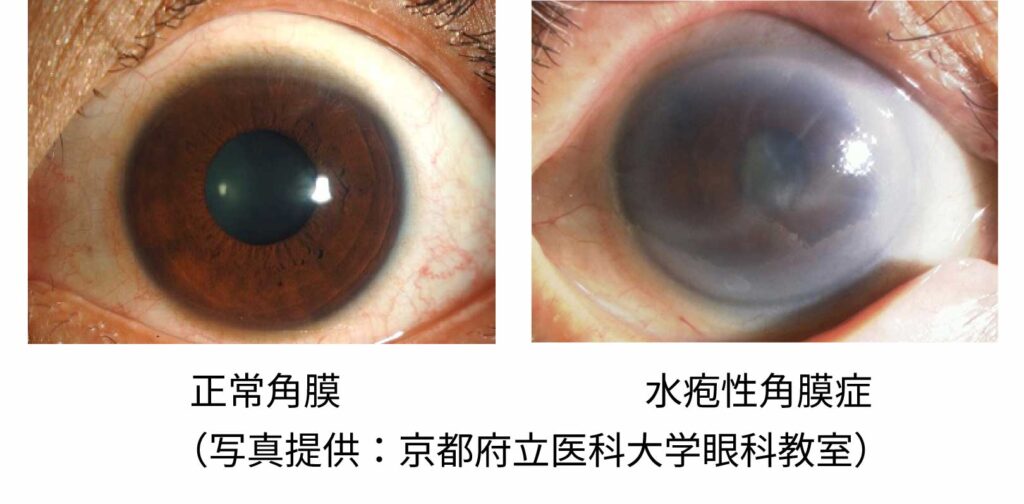
水疱性角膜症の発症原因としては白内障や緑内障などの眼科手術時の外傷、先天性の角膜編成疾患(フックス角膜内皮ジストロフィーなど)、角膜の炎症などがあります。水疱性角膜症の有効な治療法は角膜移植ですが、ドナー不足が問題となっています。
【製造および治療の流れ】
製造方法
ビズノバは角膜組織から取り出し培養・増殖させた角膜内皮細胞の懸濁液です。角膜内皮細胞は生体内では増殖しませんが、京都府立医科大学の木下茂 教授らのグループはROCK阻害剤を用いることで角膜内皮細胞を増殖させることのできる細胞培養法を確立しました。
さらに複数の細胞表面抗原の組み合わせにより生体内の角膜内皮細胞と相同の機能を有する成熟分化型培養ヒト角膜内皮細胞の集団を同定し、培養法を改良することで機能的な成熟分化型培養ヒト角膜内皮細胞を安定的かつ効率的に製造することを可能にしています。
これらの製造法により、1人のドナーの角膜から1,000人以上の患者の治療に使用できるだけの培養角膜内皮細胞を得ることができます。(参照:Aurion Biotech, Inc.ウェブサイト Products)
製造はS-RACMO株式会社に委託されています。
治療の流れ
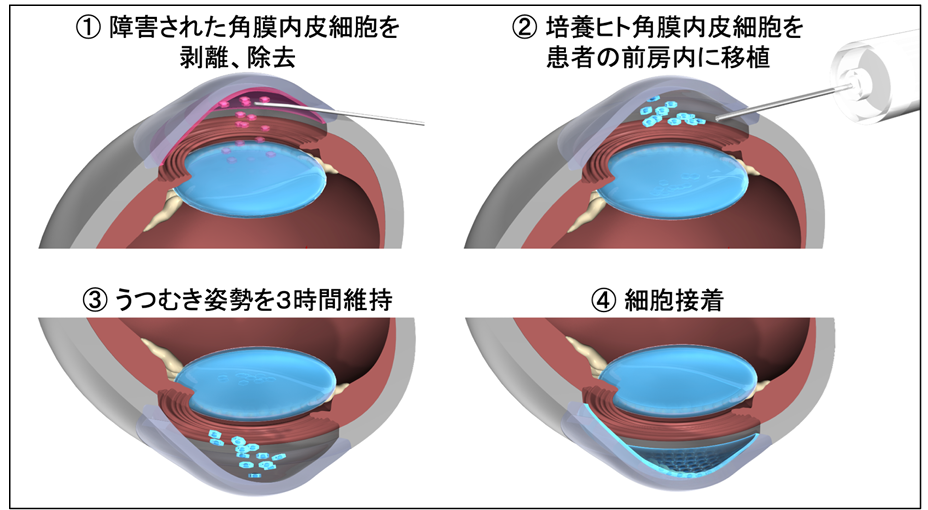
ビズノバは凍結製品ではないため、製造後すぐに医療機関に冷蔵状態で輸送され治療に使用されます(製品の有効期間は細胞剥離開始後27時間)。
移植前に水疱性角膜症の患者角膜の障害された角膜内皮細胞を剥離,除去し、前房内に100万個の培養角膜内皮細胞が注入移植されます。移植後、3時間うつ伏せ状態をとることで移植した細胞を角膜上に接着させます。
【臨床成績】
ビズノバでは、国内第Ⅱ相探索的医師主導試験(CHCEC-201試験)、および国内第Ⅲ相検証的医師主導試験(CHCEC-301試験)が行われています。
国内第Ⅱ相探索的医師主導試験(CHCEC-201試験) (UMIN-CTR 臨床試験登録情報)
| 試験デザイン | 多施設共同、二重盲検、ランダム化、並行群間比較、単回注 入、医師主導試験 |
| 対象 | 水疱性角膜症患者 |
| 対象患者数 | 15例 |
| 試験方法 | 被験者は3 群に割り付けられ、以下のいずれかの用量の試験製品を前房内へ移植 ・低用量群(前房内移植細胞量 2×105個/眼) ・中用量群(前房内移植細胞量 5×105個/眼) ・高用量群(前房内移植細胞量 1×106個/眼) |
| 主要評価項目 | 移植後12週における角膜内皮細胞密度が1000個/mm2 以上となる患者の割合 |
試験結果
| 有効性評価 | 主要評価項目達成の割合 全体:13/14例 (他、測定不可1例) ・低用量群:4/5例 ・中用量群:4/4例 (他、測定不可1例) ・高用量群:5/5例 |
国内第Ⅲ相検証的医師主導試験(CHCEC-301試験) (UMIN-CTR 臨床試験登録情報)
| 試験デザイン | 多施設共同、非盲検、単回注入、医師主導試験 |
| 対象 | 水疱性角膜症患者 |
| 対象患者数 | 12例 |
| 試験方法 | 移植細胞量として1×106 個/眼の用量で前房内へ移植 |
| 主要評価項目 | 移植後24週における角膜内皮細胞密度が1000個/mm2 以上となる患者の割合 |
試験結果
| 有効性評価 | 主要評価項目達成の割合 12/12例 (100%) |
