
| 販売名 | ルクスターナ®注 |
| 一般的名称 | ボレチゲン ネパルボベク |
| 製造販売者 | ノバルティスファーマ株式会社 |
| 対象疾患 | 両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィー |
| 承認日/保険収載日 | 2023年6月26日/2023年8月23日 |
| 保険償還価格 | 49,600,226円 (再生医療等製品の保険適用について(中医協 総-2, 5. 8. 23)) |
| 関連文書 | 製品基本情報(添付文書/インタビューフォーム) 審査報告書 (PMDAウェブサイト) 申請資料概要 (PMDAウェブサイト) |
【製品概要】
ノバルティスファーマDR’s Net ルクスターナ
ルクスターナ®注(以下、ルクスターナ)は両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィーに対する遺伝子治療製品です。遺伝性網膜ジストロフィーの原因遺伝子のひとつであるヒトRPE65遺伝子を組み込んだアデノ随伴ウイルス2型(AAV2)ベクターであり、網膜下に単回投与することで網膜色素上皮細胞に正常なヒトRPE65遺伝子が導入され、生涯に渡り安定かつ持続的に網膜の機能を回復します。
約4960万円と国内ではゾルゲンスマに次ぐ高額な薬価が設定されています。治療は原則として両目に対して行われるため、実際の治療では約1億円分のルクスターナが使用されます。再生医療等製品の保険適用について(中医協 総-2, 5. 8. 23)での市場規模予測では、ピーク時の患者数5人、販売金額5億円と予測されています。
製品名は、生来の光を感知する力を取り戻すという意味で、「LUX」=光、「TURNA」=生来の、という語の組み合わせにより命名されています 。
【対象疾患と作用メカニズム】
対象疾患
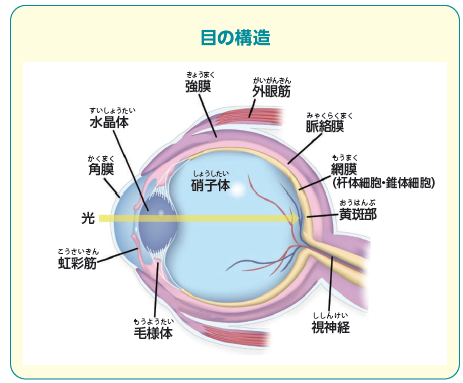
遺伝性網膜ジストロフィーは遺伝子異常が原因で起こる網膜変性疾患の総称です。網膜は眼の最奥部に位置する膜であり、目に入った光は網膜により神経信号に変換され視神経を通じて脳に送られます。遺伝子の変異により網膜の機能が障害されることで夜盲、視野狭窄、視力低下などを生じる疾患が遺伝性網膜ジストロフィーです。国内に約2~3万人、世界では約200万人の患者がいるとされています。
これまでは根治的な治療法はなく、アダプチノール®の服用により進行を遅らせたり、視覚補助具などによるロービジョンケアによる対応がされてきました。
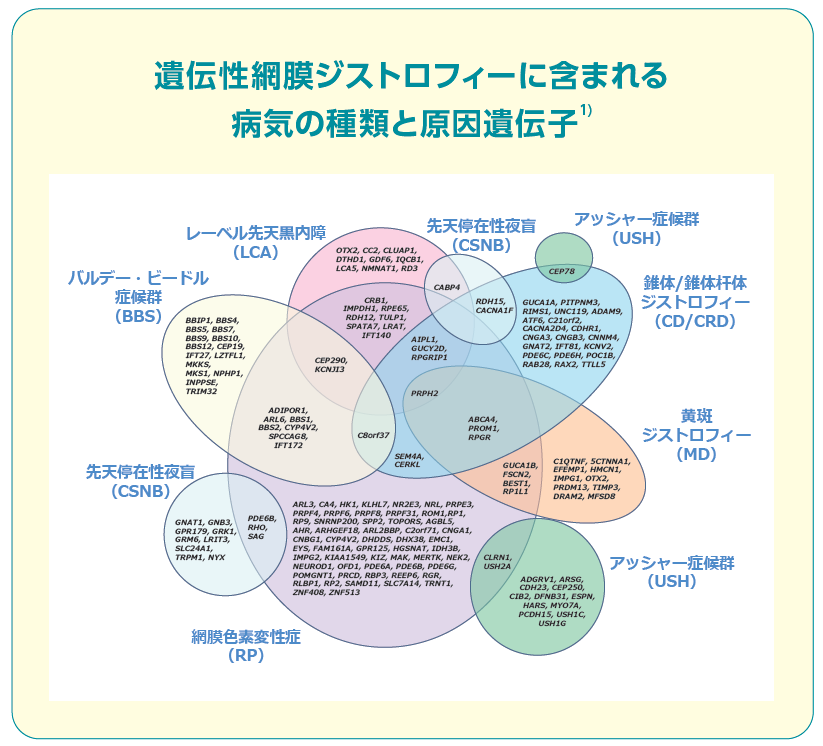
遺伝性網膜ジストロフィーの原因遺伝子として多くの遺伝子が特定されており、遺伝子の種類によりいくつかの疾患に分かれます。
ルクスターナは遺伝性網膜ジストロフィーの代表的な病気である網膜色素変性やレーベル先天黒内障の原因遺伝子のひとつである「RPE65遺伝子」に変異のある患者を対象としており、正常なhヒトRPE65遺伝子を網膜色素上皮細胞に補充することで症状を改善します。
構造および作用メカニズム
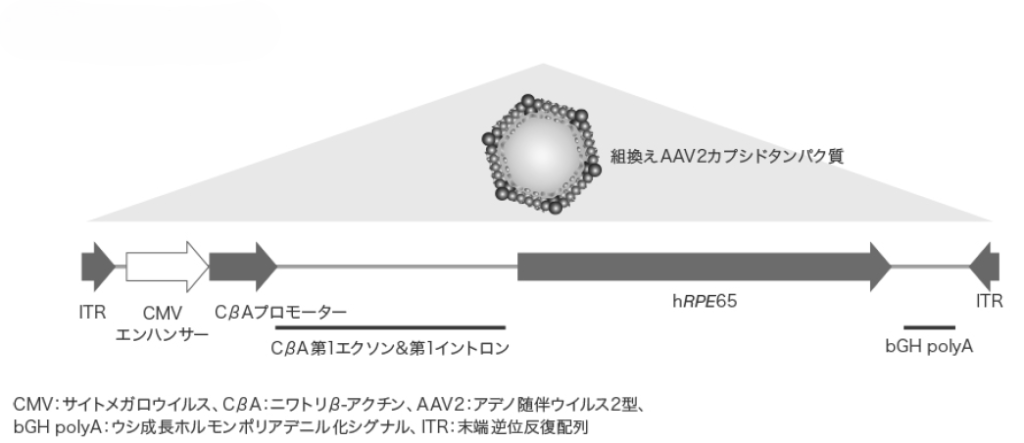
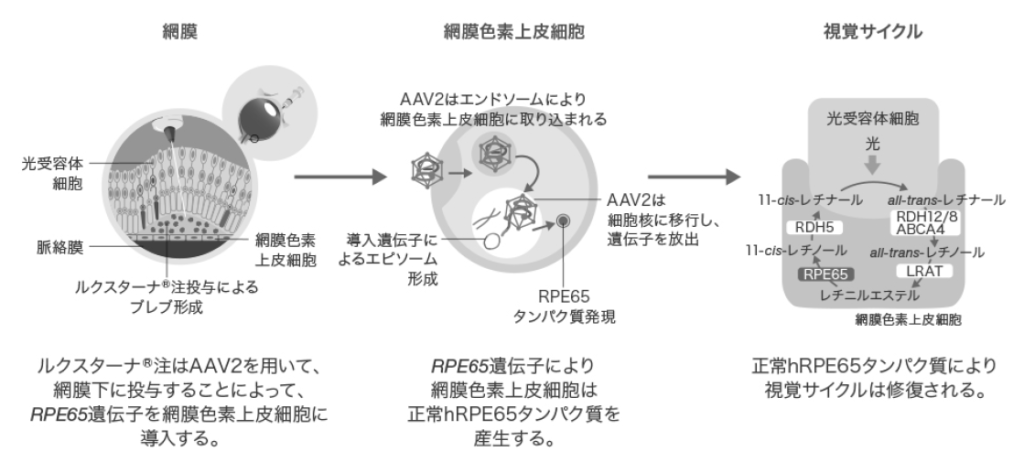
ルクスターナはアデノ随伴ウイルス2(AAV2)ベクターにヒトRPE65遺伝子配列を組み込んだ遺伝子治療製品です。網膜下への単回投与により、異常な網膜色素細胞へ遺伝子を導入します。
導入された遺伝子は染色体に組み込まれることなくエピソーム(安定的に細胞内に維持される環状DNA)として核内に存在し、正常ヒトRPE65タンパクを発現させることで網膜の機能を回復させます。生体内では網膜色素上皮細胞はほぼ分裂しないため、導入された遺伝子も長期に安定的に存在するため、理論的には生涯に渡って効果が継続します。
【臨床成績】
ルクスターナの開発では、海外での第I相試験(101試験、102試験)、海外での第III相試験(301試験)、および国内第III相試験(A11301試験)が行われています。
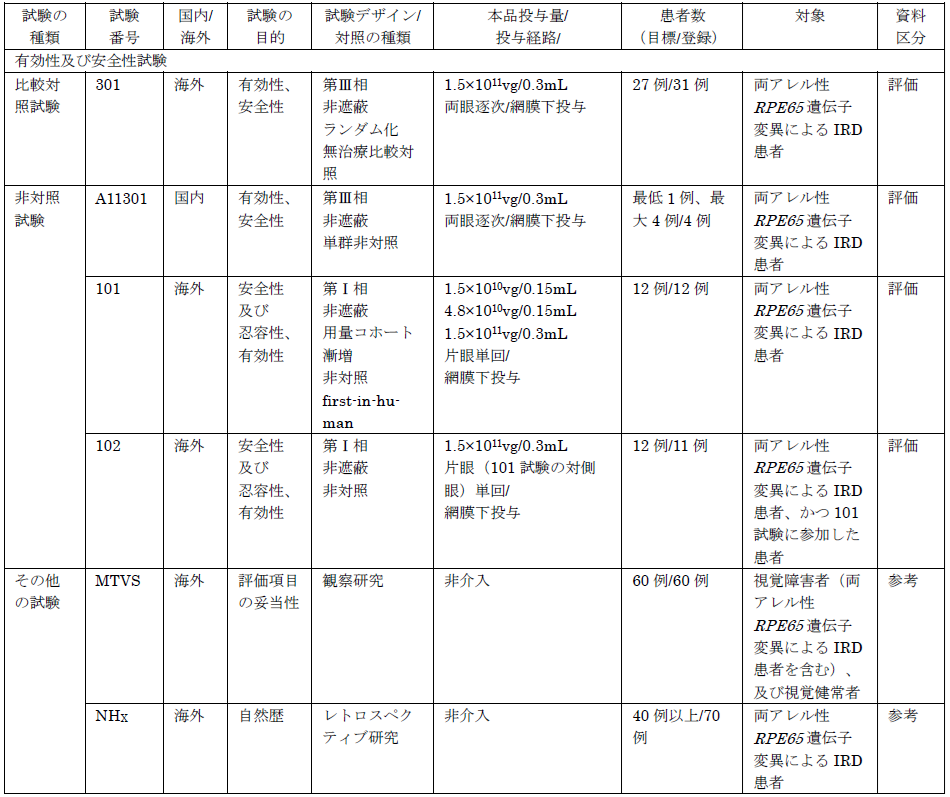
海外第Ⅲ相試験 (301試験)
| 試験デザイン | 非遮蔽、ランダム化、無治療比較対照 |
| 対象 | 両アレル性RPE65遺伝子変異によるIRD患者 |
| 患者数 | 31例 (介入群:21例、対照群:10例) |
| 投与量/投与経路 | 1.5×1011 vg/0.3 mL/両眼逐次/網膜下投与 |
| 主要評価項目 | Year 1 B (介入群)/C (対照群)の両眼MLMTスコア(※)のベースラインからの平均変化量 ※MLMTスコア:Multi-luminance mobility test。異なる照度レベルの環境下で、決められたコースを正確かつ妥当な速度で移動できる能力スコア |
試験結果
| 有効性評価 | 投与1年後の両眼MLMTスコア変化量 介入群:1.8±1.1 対照群:0.2±1.0 |
国内第Ⅲ相試験 (A11301試験)
| 試験デザイン | 非遮蔽、単群非対照試験 |
| 対象 | 両アレル性RPE65遺伝子変異によるIRD患者 |
| 患者数 | 4例 (介入群:4例) |
| 投与量/投与経路 | 1.5×1011 vg/0.3 mL/両眼逐次/網膜下投与 |
| 主要評価項目 | FST (両眼平均、視標:白色光)のベースラインからの平均変化量 ※FST:Full Field Stimulus Threshold test。フラッシュを認識することができる最低輝度を推定することによって視野全体の感度を測定するテスト |
試験結果
| 有効性評価 | 投与1年後のFST -1.831 (-3.54~-0.56) |
