
〇抗原特異的な誘導型抑制性T細胞JB-101を用いた、臓器移植後の免疫抑制療法の開発
〇生体肝移植における医師主導臨床第I/II相試験を開始
〇富士フィルム社およびJ-TEC社と提携し、再生医療製品の開発を進行中
| 会社名 | 株式会社 JUNTEN BIO |
| 所在地 | 東京都中央区日本橋2丁目1番3号 アーバンネット日本橋二丁目ビル10階 |
| 代表者 | 代表取締役社長 河南雅成 |
| 設立 | 2018年6月 |
| 上場 | 非上場 |
【会社概要】
抗原特異的な誘導型抑制性T細胞を用いて、臓器移植後の免疫抑制療法の開発を進める順天堂大学発のバイオベンチャーです。順天堂大学大学院医学研究科の奥村康 特任教授(JUNTEN BIO社取締役)や場集田 寿 助教(同取締役)らが進めていた、誘導型抑制性T細胞の治療実用化を目的に設立され、代表取締役を株式会社ジーンテクノサイエンスの元会長である河南雅成 氏が務めています。
誘導型抑制性T細胞JB-101は、2020年度の先駆け審査指定制度対象品目に指定されており、生体肝移植における医師主導治験が開始されています。
【事業内容】
抗原特異的誘導型抑制性T細胞
①T細胞活性化メカニズム

T細胞の活性化においては、まず抗原提示細胞(APC)が提示した抗原/MHC複合体をT細胞レセプター(TCR)を介して認識します。その後、共刺激分子(もしくは補助刺激分子)と呼ばれる、抗原提示細胞上のCD80/CD86とT細胞上のCD28が結合することで、T細胞は活性化され、増殖やサイトカインの産生を行うようになります。
②抗原特異的なT細胞の不応答化
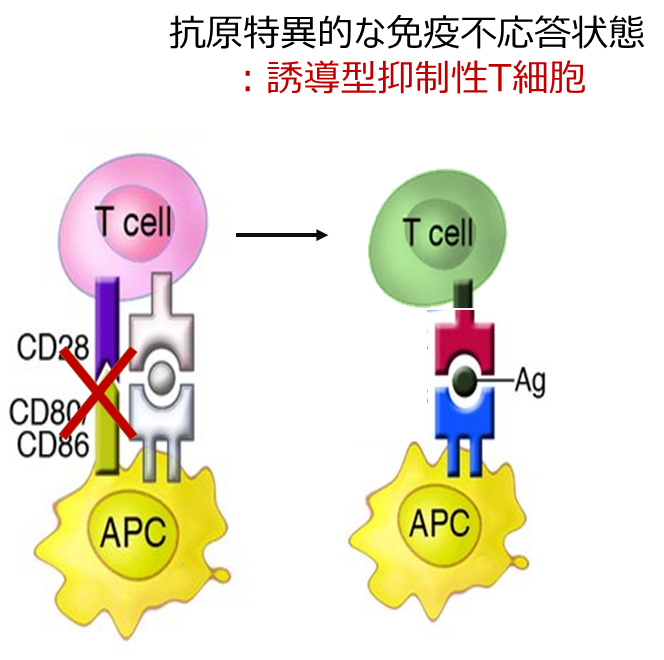
T細胞が抗原提示を受けた時に共刺激分子のシグナルを受け取れなかった場合、T細胞は活性化されず、免疫不応答なT細胞(Anergic T cell)となります。この不応答状態は持続的で、再度同じ抗原に遭遇してもT細胞の活性化は起こりません。また、自身の不活性化のみでなく、ほかのT細胞の活性化に対しても抑制的に働くことが知られています。
誘導型抑制性T細胞による免疫抑制療法
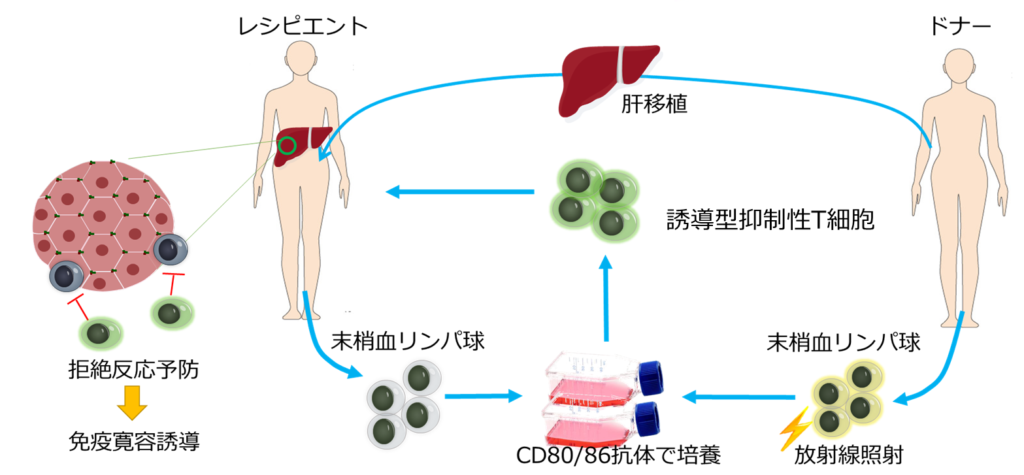
誘導型抑制性T細胞を用いた、臓器移植後の免疫抑制治療の開発が進められています。
臓器移植を受けた場合、免疫拒絶反応を抑えるために生涯に渡り免疫抑制剤を服用する必要があります。しかしながら、長期服用においては副作用として、悪性腫瘍、感染症、高血圧、糖尿病等の合併症を起こす危険性があります。
そこで、臓器移植後に抗原特異的誘導型抑制性T細胞を投与することで、免疫抑制剤の投与なしに免疫寛容の状態を誘導する治療法の開発が進められています。
患者血液から取り出したT細胞を含む末梢血リンパ球と、ドナーから取り出した血液細胞を混合し、抗CD80/CD86抗体の存在下で培養することで、ドナー抗原に対する誘導型抑制性T細胞が誘導されます。この誘導型抑制性T細胞を臓器移植後に投与することで、免疫寛容を誘導します。
①動物試験

順天堂大学大学院医学研究科の奥村特任教授(JUNTEN BIO社取締役)や場集田助教(同取締役)らは、東京女子医科大学や理化学研究所、日本医科大学と共同して、アカゲザルでの腎移植において、誘導型抑制性T細胞による免疫抑制の効果を確認しています。
②生体肝移植 臨床試験
北海道大学病院を中心として、生体肝移植後において誘導型抑制性T細胞投与の第I/II相臨床試験が2010年から行われました。この試験では、生体肝移植後において術後2週目までは標準的免疫抑制療法を行い、その後誘導型抑制性T細胞の投与を開始するとともに、免疫抑制剤の投与量を徐々に減らしています。その結果、10例中7例で免疫抑制剤投与の減量・中止に成功しています(残りの3例は、免疫抑制剤維持により肝機能は正常化)。
現在、多施設における第II相臨床試験が進められています。ただし、JUNTEN BIO社と同臨床試験の関連は明らかではありません。
③生体腎移植 臨床試験
東京女子医科大学腎臓外科では、2008年に生体腎移植において誘導型抑制性T細胞投与の臨床試験を行っています。
上記肝移植と同様に、免疫抑制剤と併用投与しながら徐々に免疫抑制剤の投与量を減らす試験を行った結果、16例中7例において、標準的免疫抑制療法の約半分まで投与量を減らすことができました。しかしながら、免疫抑制剤の投与中止までには至らず、また9例においては投与量の減量時に急性拒絶が見られるなど、肝移植で見られたような良好な成績は得られていません。
現在、改良を加え新たなプロトコールを作成するなど、引き続き研究が進められています。
再生医療等品の開発
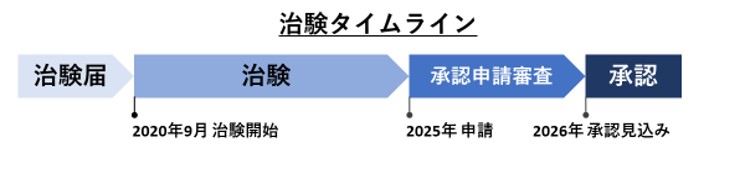
再生医療等製品としての開発を目的に、2020年9月に順天堂大学と共同で「生体肝移植における誘導型抑制性T細胞(JB-101)による免疫寛容誘導能及び安全性を評価するI/II相臨床試験」の治験届を提出し、医師主導治験を開始しています。JB-101は2020年度(令和2年度)の審査指定制度対象品目に指定されており、2026年の承認を目指しています。
2019年6月に、富士フィルム株式会社から2億円の出資を受けるとともに、富士フィルム子会社の株式会社ジャパン・ティッシュ・エンジニアリング(J-TEC) と、再生医療製品の開発に関する業務委託契約を結んでいます。この契約に基づいて、J-TEC社から薬事コンサルティングを受けながら再生医療製品の開発が進められます。
